Desde hace tiempo ya se puede identificar especies mediante técnicas genéticas, aunque las personas comunes lo veíamos como de película; pero actualmente ya no es tan complejo, ni tan caro encargar a un laboratorio que te analice un trozo de tejido y te identifique la especie. Hay más, como las técnicas genéticas son tan sensibles, en 2011 se empezó a hablar del eDNA (environmental DNA) o ADN ambiental. Es decir que no hace falta ver la especie para saber que está en un ecosistema, en el agua se disuelven las deyecciones, restos de piel, etc. que tienen ADN y que se pueden detectar. En nuestro caso, tomando una muestra de agua se puede amplificar el ADN que exista para poder identificar la especie que buscamos.
Para explicarlo un poco, el procesado de una muestra de eDNA es la siguiente:
Tomamos una muestra de agua, aproximadamente un litro. Se filtra la muestra, de tal manera que se transfiera el ADN al filtro y éste se lleva a un volumen mucho más reducido con una solución característica para producir la lisis y liberar al ADN en la solución. Se purifica la muestra mediante distintas técnicas y entonces ya se puede proceder a la amplificación: copiarlo muchas veces para que se pueda trabajar con él.
La muestra de ADN se amplifica por medio del proceso de PCR, siglas en inglés de Reacción en Cadena de la Polimerasa. Para conseguir la replicación del ADN debemos rodear la muestra de una mezcla de nucleótidos y de la encima polimerasa, que es la que facilita la reacción, esa mezcla se llama mezcla maestra o “Master mix”. En primer lugar debemos separar las dos hebras de la cadena de ADN (la doble hélice), esto se consigue mediante una subida de temperatura hasta los 90ºC, inmediatamente se baja hasta una temperatura más adecuada para que comience la reacción. Para amplificar únicamente el ADN que nos interesa, se incluyen en la mezcla unos cebadores o “primers” que son unos trozos de ADN característicos de la especie que buscamos y que se pegan al ADN de la muestra, siempre que sea de la especie objetivo, y permiten a la ADN polimerasa que comience a pegar nucleótidos a partir del cebador. Cuando termina su trabajo, tenemos el doble de cadenas de ADN. Para tener suficiente ADN se repite el proceso entre 20 o 50 veces. Para hacernos una idea, si se parte de 2 cadenas de ADN y se repite el proceso 40 veces teóricamente obtendríamos 1 billón de cadenas, cantidad suficiente para verlo a simple vista y detectarlo con seguridad.
El último paso es la identificación del ADN producido en la PCR, que normalmente se realiza mediante una electroforesis en un gel de agarosa.
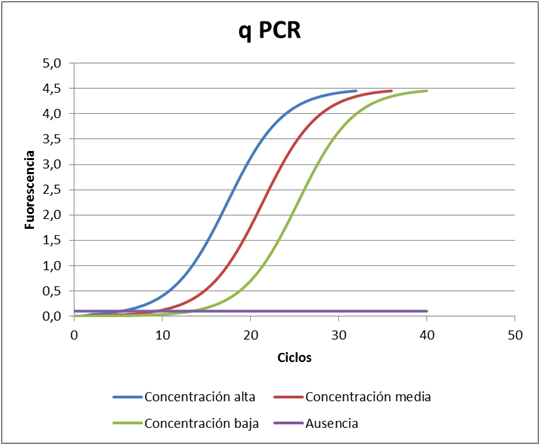
Pero los avances en la identificación de especies mediante técnicas genéticas no se ha quedado ahí. Actualmente está disponible la técnica de la qPCR (quantitative PCR), llamada así por ser una PCR que permite cuantificar el número de cadenas de ADN que hay en la muestra. También se conoce con el nombre de PCR in situ, ya que los resultados se pueden obtener en muy poco tiempo. Para explicar las diferencias con la PCR normal, voy a poner el ejemplo de la especie exótica invasora con la que estamos trabajando: el caracol del cieno, Potamopyrgus antipodarum.
El comienzo del proceso es similar: toma de muestra, filtrado, lisis y lavado con distintos buffer: de proteínas, salino, de secado; para luego eluir el ADN, ya puro, antes de mezclarlo con una mezcla maestra que incluye una sonda con un fluoróforo que emite luz cuando se une al ADN, por lo tanto, a medida que se duplica el ADN se va emitiendo luz y cuanto más ADN exista en la muestra, más rápido se alcanzan las intensidades de luz prefijadas y por tanto, si hemos realizado una curva patrón que nos relacione biomasa con luminiscencia podremos estimar la biomasa de la muestra. Otra de las ventajas de este método es que no hace falta el posterior proceso de electroforesis en gel, porque cuando acaba la PCR ya tenemos los resultados.
En el proceso de purificación se tardan 5 minutos y no es necesario el uso de ningún aparato de laboratorio habituales en la purificación: centrífugas, electroimanes, etc. La PCR se realiza en un termociclador que pesa menos de un kilo y que es totalmente portátil. Los 45 ciclos que recomiendan en el protocolo tardan 50 minutos. En consecuencia, en menos de una hora tenemos los resultados, después de filtrar la muestra (que se puede hacer con jeringas de gran volumen). Además no hace falta llevársela al laboratorio, todo el trabajo se puede realizar en el campo.
Nuestro equipo de trabajo (que incluye a Everis Ingeniería, Ecohydros y la Universidad de Oviedo) está en camino de desarrollar cebadores para especies invasoras, para especies protegidas, para especies interesantes para la acuicultura e incluso para detectar especies con elevado valor comercial. Si las condiciones son normales, en 6 meses se puede desarrollar un cebador para una especie nueva.
En consecuencia, existe la herramienta y la posibilidad de adecuarla a las necesidades de cada uno en un tiempo razonable. Lo único que falta son proyectos interesantes donde aplicarlo. Pensemos en las especies protegidas, es una técnica que no nos obliga a capturarlas para saber dónde están, lo cual es importantísimo si el número de individuos de la población es bajo.
Si la qPCR es una herramienta del presente, el metabarcoding lo es del futuro. El método parte de una amplificación de ADN por PCR, pero usando cebadores inespecíficos que permiten que el ADN de todas las especies se amplifique, no sólo el de una, como antes hacíamos. Después se secuencian los fragmentos amplificados y por comparación con una base genética podemos identificar a todas las especies que hay.
Las posibilidades de esta metodología son brutales, nos olvidaremos de las personas mirando durante horas por una lupa para identificar las familias de macroinvertebrados. Se desarrollarán índices a nivel de especie que serán mucho más sensibles que los que ahora tenemos. Con una muestra de agua podremos decir todos los peces que hay en una laguna, no hará falta pescarlos, lo que le produce mucho estrés y en algunos casos muerte de algunos ejemplares. Etcétera, etcétera.
Mariano Cebrián y Pedro Pablo Loné colaboran con el ISM como docentes del curso Gestión y Monitorización de la Calidad de las Aguas donde se profundiza en el análisis de indicadores biológicos para la evaluación de la calidad de aguas.
















Deja tu comentario